Земля и космос
|
Заполняем пробелы (Часть 3) В 1869 году русский химик Дмитрий Иванович Менделеев попытался организовать элементы согласно молекулярной массе и валентности. Результатом стала система, очень упрощенную и неполную версию которой я привожу в таблице 1 с атомными весами, округленными до одной десятой после запятой. В таблице 1 я даю химические элементы так, чтобы сэкономить место; это не повлияет на систему доказательств и ни в коей мере не запутает, даже если вы не знаете, каким символом какой элемент обозначен. Когда мне придется упомянуть определенный элемент, я дам его полное название, вместе с символом. Строки в таблице 1 содержат тесно связанные семейства элементов. К примеру, верхняя строка содержит литий (Li), натрий (Na), калий (К), рубидий (Rb), цезий (Cs) и франций (Fr), которые имеют одинаковые свойства. Эти элементы медленно плавятся, исключительно активны и ири определенных условиях реагируют примерно одинаково. Более того, там, где различия существуют, они проявляют себя постоянным изменением вдоль строки. От лития к натрию, калию и так далее точка плавления вещества становится ниже, а активность его возрастает. Эти шесть элементов называют щелочными металлами. Вторая строка содержит шесть щелочноземельных элементов, которые тоже имеют сходные свойства. И так далее на протяжении таблицы. Заметим, что в периоде 5 теллур (Те) идет перед йодом (I), хотя теллур имеет большую атомную массу, а значит, должен находиться после йода, если бы классификация шла только по атомной массе. Именно Менделееву принадлежит великая заслуга в том, что валентность (как и химические свойства в целом) стала учитываться в первую очередь по отношению к атомной массе. Для того чтобы поместить теллур и йод в надлежащее семейство с надлежащей валентностью, пришлось поменять порядок следования атомной массы. Более сложное знание атомной структуры, обретенное химиками в дальнейшем, доказало, что в этом отношении интуиция Менделеева оказалась абсолютно правильной. Когда мы перемещаемся вниз по списку элементов согласно их молекулярной массе, периодически повторяется определенный набор свойств — по этой причине этот список, организованный так, что определенные наборы укладываются точно в строки или колонки, называются периодической таблицей. В то время, когда Менделеев впервые выдвинул свою Периодическую систему, значительное число элементов, приведенных в таблице 1, еще не было открыто. Они указаны в таблице 1 звездочкой. 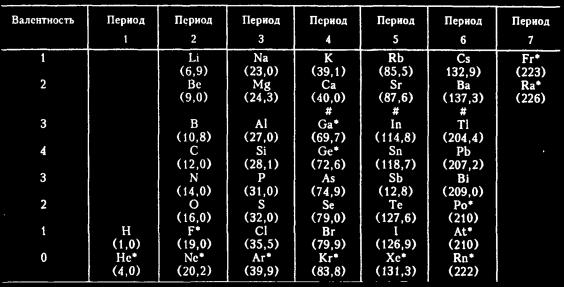 К примеру, шесть элементов в строке внизу — гелий (Не), neon (Ne), аргон (Аг), криптон (Кг), ксенон (Хе) и радон (Rn) — не были известны в 1869 году. Об их существовании совершенно не представляли, и без них Периодическая система, казалось, имела законченный вид. Если идти последовательно сверху вниз в порядке атомных весов элементов, то изменение валентности в таблице 1 происходит (если исключить нижний ряд) по следующему порядку: 1, 1, 2, 3, 4, 3, 2, 1, 1, 2, 3, 4, 3, 2, 1, 1, 2 и так далее. Однако, когда были открыты элементы в нижней строке, оказалось, что они не вступают в соединения с любыми другими элементами и, следовательно, имеют пулевую валентность. Таким образом, последовательность валентностей изменилась на следующую: 1, 0, 1, 2, 3, 4, 3, 2, 1, 0, 1, 2, 3, 4, 3, 2, 1, 0, 1, 2 и так далее. Элементы нижней строки, имеющие схожие свойства и называемые инертными газами, или благородными газами, просто расширили таблицу, но не нарушили ее порядок. Наоборот, введение 0 в надлежащем месте сделало таблицу даже «элегантнее». Тот факт, что эта весьма неожиданно обнаруженная группа элементов столь превосходно вписалась в Периодическую систему, послужил дополнительным доказательством концепции Менделеева. Для того чтобы сохранить аргон (Ar) на своем правильном месте в семействе инертных газов, его следует поставить перед калием (К), даже хотя это меняет порядок следования по молекулярным массам. И снова это повторилось в таблице с теллуром (Те) и йодом (I). Заметим также, что в таблице 1 пять элементов с самыми большими атомными массами были неизвестны во времена Менделеева. Это полоний Ро), астат (At), радон (Rn), франций (Fr) и радий (Ra). Эти элементы были обнаружены в 1890-х и в последующие годы; они являются радиоактивными. Все эти элементы относятся к нестабильным и присутствуют в земной коре в очень малых количествах. Поскольку все они располагаются в конце таблицы, их отсутствие не влияло на все остальные. Затем возник фтор (F), который, строго говоря, не был хорошо изучен во времена Менделеева. Это очень своеобразный элемент. Фтор был обнаружен в различных соединениях, из которых его извлечь не удавалось. Свойства фтора были известны, но на основании свойств его соединений. Его связи в соединениях оказались столь тесны, что только в 1886 году химики смогли выделить фтор из соединений, чтобы исследовать этот элемент в чистом виде. Даже малоизученный, фтор присутствовал в таблице с самого начала (это напоминает ситуацию с глобусом, северные и южные поля которого были обозначены, даже несмотря на то, что полюсов достигнуть пока не удалось). Было еще два элемента таблицы, галлий (Ga) и германий (Ge), с особой судьбой. После их обнаружения не пришлось искать, поместить ли их в последний ряд или последнюю строку, чтобы они не нарушали общий порядок. Хотя об их существовании не подозревалось, для них оставили «вакантное место» в середине таблицы. Если бы это место не было оставлено и будущие галлий и германий были бы проигнорированы, то при попытке перечислить элементы в порядке атомных масс пришлось бы поместить мышьяк (As) справа от алюминия (А1) и селена (Se) и справа от кремния (Si) и т. д. Это бы совершенно разрушило организацию по семействам н валентности. Менделеев отказался от этого, и это было одним из величайших его достижений. Он поместил мышьяк (As) справа от фосфора (Р), а селен (Se) справа от серы (S), где их места соответствовали их свойствам. Поскольку это оставило два свободных места справа от алюминия (А1) и кремния (Si), Менделеев решил, что они предназначены для двух элементов, которые еще только предстояло открыть. Он назвал их эка-алюминий и эка-кремний, «эка» — санскритское слово, обозначающее единицу. Другими словами, отсутствующие элементы находились на одно место справа от алюминия и кремния соответственно. Более того, Менделеев предсказал свойства отсутствовавших элементов с большой точностью — он счел, что галлий (Ga) будет иметь свойства, промежуточные между алюминием (Аl) и индием (In), а германий (Ge) — промежуточные между кремнием (Si) и цинком (Sn). Поначалу большинство химиков мира снисходительно улыбались на «этого сумасшедшего русского», но в 1875 году был открыт галлий, а в 1886 году германий, и предсказания Менделеева сбылись во всех отношениях. Химики перестали смеяться. |
Статьи:
Видео:
Последние новости:
| Гранулы |
| Инстинкты и разум. Часть 2 |
| У близкой звезды Эпсилон Эридана есть планета |
| Земля ночью |
| Долина Маадим |
Видео:
 | Hubble 20th: Carina Nebula |
 | Путешествие на край Вселенной. часть 6/10 |
 | Kepler Overview |
Последние новости:
| Зонд НАСА рассмотрел ледяные горы на поверхности Плутона |
| На Землю надвигается сильный метеоритный дождь |
| NASA создаст роботов для ремонта и дозаправки спутников |
| Россия и Япония совместно построят космический телескоп |
|
WalkInSpace.Ru Правила: «Путешествие в космос» © 2024 Использование материалов допускается при условии указания авторства WalkInSpace.ru и активной ссылки на www.WalkInSpace.ru. |
|


